
Dalton hat das Atommodell entworfen, oder genauer gesagt als Hypothese formuliert um das Gesetz von der Erhaltung der Masse, das Gesetz der konstanten Mengenverhältnisse und das Gesetzt der multiplen Proportion zu erklären. Seine drei Hypothesen lauten wie folgt:
Diese sehr einfache Modell erlaubt es die Massengesetze zu erklären. Desgleichen bildet das Modell die Grundlage für die Erklärung des Teilchenmodells und die Aggregatzustände.

Am Ende des 19. Jahrhunderts wurden viele neue Entdeckungen in den Naturwissenschaften gemacht.
1897 hat der englische Physiker bei Versuchen mit der Kathodenstrahlröhre die Existenz von kleinen negativ geladenen Teilchen, Elektronen (e-), nachgewiesen. Da er diese Teilchen in seinen Versuchen aus allen Metallen gewinnen konnte musste er schließen dass diese Elektronen im Metall enthalten sind, und somit das Atom nicht unteilbar ist sondern aus kleineren Teilchen aufgebaut ist.
1886 entdeckt der Physiker Goldstein dass die Atome denen Elektronen entrissen wurden ein positive Ladung tragen. Diese positive Ladung wird von den Protonen (p+) getragen. Die Atome, die nach außen hin neutral sind, bestehen also aus Elektronen und Protonen.
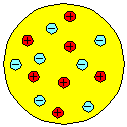
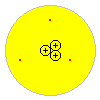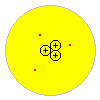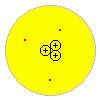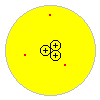
Das Atommodell von Thomson besteht deshalb aus genauso vielen positiven wie negativen Teilchen, um die Neutralität des Atoms zu gewährleisten, die gleichmäßig im massiven Atom verteilt sind.
Anfangs des 20. Jahrhunderts verfügten die Wissenschaftler mit der Entdeckung der Radioaktivität über ein neues Werkzeug um den Aufbau der Materie zu untersuchen.Rutherford und seine Mitarbeiter Geiger und Marsden beschossen ein dünnes Goldblatt mit den so genannten Alpha-Teilchen (a-Teilchen). Das sind kleine positiv geladene Teilchen, die eine Art der radioaktiven Strahlung bilden. Die Strahlenquelle wurde so in einen Bleiblock eingebettet, dass nur ein dünner Teilchenstrahl herauskommt.
Um die Flugbahnen der a-Teilchen zu bestimmen nutzt man die Tatsache aus, dass a-Teilchen einen fotografischen Film schwärzen wenn sie auftreffen. Dort wo der Film nach dem Entwickeln schwarz ist haben a-Teilchen eingeschlagen.
Rutherford hat den Film in einem Kreis um das Goldblatt angeordnet und die a-Teilchen während langer Zeit auf die Goldfolie geschossen. Anschließend wurde der Film entwickelt um die Flugbahn der Teilchen zu bestimmen.
Das Ergebnis war mit dem damaligen Atommodell nicht vereinbar.
Daraus wurde das Atommodell nach Rutherford entwickelt.
Das Atom besteht aus einem kleinen massiven, positiv geladenen Kern, der die Protonen enthält. Dieser Kern trägt fast die gesamte Masse des Atoms.
Der Kern ist umgeben von einer großen, negativ geladenen, fast masselosen Hülle in der sich die Elektronen befinden. Die Elektronen befinden sich auf einer Kreisförmigen Umlaufbahn um den Kern.
Wenn man die Größe des Atomkerns mit der Größe des gesamten Atoms vergleicht, stellt man fest dass der Kern 100 000 mal kleiner ist als das gesamte Atom. Um diesen Unterschied zu veranschaulichen muss man sich den Atomkern als Kirschkern vorstellen. Wenn der Atomkern einem Kirschkern entspricht, hat das gesamte Atom den Durchmesser der der Höhe des Eifelturms entspricht.
Jedes Atom besitzt eine bestimmte Anzahl von Protonen. Die Anzahl der Protonen definiert um welches Element es sich handelt.
Ein Element mit 17 Protonen ist immer Chlor. Die Zahl der Protonen kann man im PSE aus der Ordnungszahl herauslesen.
Die Zahl der Elektronen entspricht der Zahl der Protonen um die positiven Ladungen auszugleichen.
Eine weitere wichtige Zahl charakterisiert das Atom: die Massenzahl.Sie gibt die Masse der Atome in u (atomaren Masseneinheiten) an. Die Masse setzt sich aus der Masse der Protonen und der Masse der Elektronen zusammen. Die Elektronen werden vernachlässigt da sie kaum Masse besitzen.
| 35,5 Cl 17 |
Massenzahl |
| Elementsymbol | |
| Ordnungszahl |
| Elementarteilchen | Symbol | Masse in u | Ladung |
| Proton | p+ | 1,00728 | positiv |
| Neutron | no | 1,00867 | neutral |
| Elektron | e- | 0,00055 | negativ |