In Kapitel 5.1 wurde gezeigt, dass die Masse bei chemischen
Vorgängen konstant bleibt. Die Masse der Edukte ist gleich der Masse der Produkte.
Wie verhalten sich nun aber die Massen der einzelnen Edukte
untereinander? Um diese Frage zu beantworten, muss man Versuche
ausführen, in denen man die Proportionen der verschiedenen
Edukte ändert.
Zuerst wird dieser Frage für Feststoffe oder Flüssigkeiten
nachgegangen:
5.2.1 Feststoffe oder Flüssigkeiten
Danach werden die Massenverhältnisse für Gase untersucht:
5.2.2 Gase
5.2.1 Feststoffe oder Flüssigkeiten
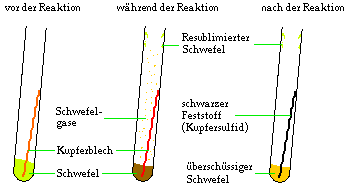
Versuch 1:
Ausführung:
In ein Reagenzglas, welches ungefähr einen Zentimeter hoch mit
Schwefelpulver gefüllt ist, gibt man ein 5 cm * 1 cm breites
Stück Kupferblech. Dann wird das Reagenzglas über der Flamme
eines Bunsenbrenners erhitzt. Wenn das Kupferblech zu glühen
anfängt, wird das Reagenzglas aus der Flamme genommen und man
lässt abkühlen.

Beobachtungen:
Wenn man das Reagenzglas erhitzt, dann beginnt der Schwefel zu
schmelzen, und man erhält eine dunkelbraune Flüssigkeit. Es
bilden sich Gase, die über das Kupferblech streichen. Auch
nachdem man das Reagenzglas aus der Flamme genommen hat, glüht
das Kupferblech vollständig durch. Gleichzeitig kann man einen
stechenden Geruch wahrnehmen.
Nach der Reaktion hat sich das Kupferblech in einen schwarzen
Feststoff verwandelt, man kann kein elementares Kupfer mehr
ausmachen. Unten im Reagenzglas befindet sich ein braun-gelber
Feststoff.
Erklärungen:
Wenn eine genügend hohe Temperatur erreicht ist, dann
verläuft die Reaktion von allein. Dabei gehen die beiden
Elemente Kupfer und Schwefel eine Verbindung ein, man erhält den
schwarzen Feststoff Kupfersulfid.
Das Kupferblech kann nur mit einer bestimmten Menge Schwefel
reagieren. Bei diesem Versuch war Schwefel im Überfluss
vorhanden, man findet auch nach der Reaktion noch
überschüssigen Schwefel, die Kupferportion jedoch hat
vollständig reagiert.
Der stechende Geruch stammt von einer Nebenreaktion: ein geringer
Teil des Schwefels verbindet sich mit dem Luftsauerstoff zu
Schwefeldioxid, ein farbloses, stechend riechendes Gas.
Versuch 2:
Ausführung:
In ein Reagenzglas, welches eine geringe Menge Schwefelpulver
enthält, gibt man ein 5 cm * 1 cm breites Stück Kupferblech.
Dann wird das Reagenzglas über der Flamme eines Bunsenbrenners
erhitzt. Wenn das Kupferblech zu glühen anfängt, wird das
Reagenzglas aus der Flamme genommen und man lässt abkühlen.
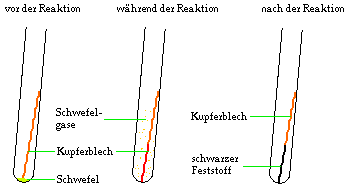
Beobachtungen:
Wenn man das Reagenzglas erhitzt, dann beginnt der Schwefel zu
schmelzen, und man erhält eine dunkelbraune Flüssigkeit. Es
bilden sich Gase, die über das Kupferblech streichen. Nachdem
man das Reagenzglas aus der Flamme genommen hat, glüht das
Kupferblech teilweise durch.
Nach der Reaktion hat sich das Kupferblech teilweise in einen
schwarzen Feststoff verwandelt, man kann aber noch sehr gut
elementares Kupfer ausmachen. Der Schwefel wurde vollständig
aufgebraucht.
Erklärungen:
Das Kupferblech benötigt eine minimale Menge Schwefel, um
vollständig zu reagieren. Bei diesem Versuch war jedoch nicht
genügend Schwefel vorhanden, man findet auch nach der Reaktion
noch unreagiertes Kupfer, die Schwefelportion jedoch hat
vollständig reagiert.
Versuch 3:
Ausführung:
Man wiederholt Versuch 1 mit verschiedenen Massen an Kupfer (0,5
g, 1,0 g, 1,5 g, 2,0 g) und jeweils einem Überschuss an
Schwefel. Bei jedem Versuch wird jedoch das schwarze Kupfersulfid
aus dem Reagenzglas genommen und in einem sauberen Reagenzglas
kurz ein zweites Mal erhitzt, um Reste von Schwefel zu
verdampfen. Dann wird das erhaltene, abgekühlte Kupfersulfid
genau abgewogen.
Man erhält folgende Tabelle:
Masse Kupfer in g |
Masse Kupfersulfid
in g |
Masse Schwefel in g |
Massenverhältnis |
0,49 |
0,62 |
0,62 - 0,49 = 0,13 |
0,49/0,13 = 3,77 |
1,02 |
1,27 |
1,27 - 1,02 = 0,25 |
1,02/0,25 = 4,08 |
1,45 |
1,82 |
1,82 - 1,45 = 0,37 |
1,45/0,37 = 3,92 |
2,15 |
2,69 |
2,69 - 2,15 = 0,54 |
2,15/0,54 = 3,98 |
Das Gesetz von der Erhaltung der Masse besagt:
Masse(Ausgangsstoffe) = Masse(Endstoffe) (1)
In diesem Fall:
Masse(Ausgangsstoffe) = m(Cu) + m(S)
Für die Endstoffe findet man:
Masse(Endstoff) = m(Kupfersulfid)
In (1):
m(Cu) + m(S) = m(Kupfersulfid)
Da m(Cu) und m(Kupfersulfid) bekannt sind, kann man m(S) durch Substraktion berechnen:
m(S) = m(Kupfersulfid) - m(Cu)
![]() Aus der
Tabelle kann man ersehen, dass das Massenverhältnis m(Cu)/m(S)
praktisch konstant bleibt (kleine Abweichungen durch
experimentelle Ungenauigkeiten sind normal). Berechnet man den
Mittelwert des Massenverhältnisses m(Cu)/m(S), dann findet man:
Aus der
Tabelle kann man ersehen, dass das Massenverhältnis m(Cu)/m(S)
praktisch konstant bleibt (kleine Abweichungen durch
experimentelle Ungenauigkeiten sind normal). Berechnet man den
Mittelwert des Massenverhältnisses m(Cu)/m(S), dann findet man:
m(Cu) 3,77 + 4,08 + 3,92 + 3,98 ----- = --------------------------- = 3,94 m(S) 4
Folglich lautet das Massenverhältnis im Kupfersulfid und
damit auch das optimale Massenverhältnis der Edukte Kupfer und
Schwefel: m(Cu)/m(S) = 3,94.
Auch für andere Reaktionen kann man die Massenverhältnisse
experimentell ermitteln. Einige Beispiele:
![]()
| Verbindung | Massenverhältnis |
| Magnesiumoxid | m(Mg)/m(O) = 1,52 |
| Silberoxid | m(Ag)/m(O) = 13,49 |
| gelbes Bleioxid | m(Pb)/m(O) = 12,95 |
| schwarzes Bleioxid | m(Pb)/m(O) = 6,475 |
| rotes Bleioxid | m(Pb)/m(O) = 9,71 |
| schwarzes Kupferoxid | m(Cu)/m(O) = 3,97 |
| rotes Kupferoxid | m(Cu)/m(O) = 7,94 |
![]()
Da man die Masse von Flüssigkeiten genau so leicht wie für
Feststoffe bestimmen kann, findet man auch dort, dass
Massenverhältnisse in den Verbindungen konstant sind. Für Gase
jedoch ist es viel leichter, das Volumen exakt zu bestimmen.
Für Feststoffe und Flüssigkeiten kann man die Masse sehr
leicht mithilfe einer Waage bestimmen. ![]() Für Gase jedoch ist das Volumen die am
leichtesten zu bestimmende Größe. Um zu untersuchen, ob auch
bei der Reaktion von Gasen ein konstantes Massenverhältnis
vorliegt, bedient man sich deshalb dieser Größe. Kennt man das
Volumen V eines Gases, so lässt sich die Masse m sehr leicht
bestimmen, wenn man die Dichte rho kennt:
Für Gase jedoch ist das Volumen die am
leichtesten zu bestimmende Größe. Um zu untersuchen, ob auch
bei der Reaktion von Gasen ein konstantes Massenverhältnis
vorliegt, bedient man sich deshalb dieser Größe. Kennt man das
Volumen V eines Gases, so lässt sich die Masse m sehr leicht
bestimmen, wenn man die Dichte rho kennt:
m = V * rho m: Masse (in Gramm, g)
V: Volumen (in Liter, l)
rho: Dichte (in Gramm/Liter, g/l)
![]() Die Dichte rho ist eine charakteristische
Eigenschaft eines Stoffes.
Die Dichte rho ist eine charakteristische
Eigenschaft eines Stoffes.
Versuch: Knallgasreaktion
Ausführung:
Da die chemische Reaktion von Wasserstoff mit Sauerstoff explosiv
verläuft, wird sie in einem besonders dafür gebauten Apparat,
dem Eudiometer, untersucht. Das Eudiometer besteht aus einem
dickwandigen Glaszylinder, in den man Gasgemische einführen
kann. Ein elektrischer Funke erlaubt die Zündung des Gemisches.
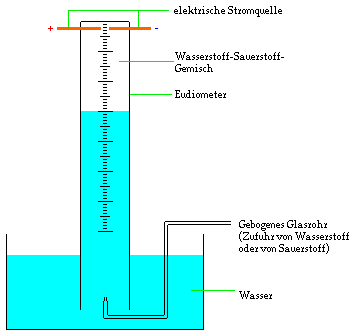
Bei der Reaktion von Sauerstoff und Wasserstoff entsteht
flüssiges Wasser. Das Volumen, welches dieses Wasser einnimmt,
ist unbedeutend im Vergleich zum Volumen, welches von den Gasen
eingenommen wird. Nach der Reaktion steigt deshalb dasWasser
teilweise im Eudiometer hoch.
Vor der Reaktion |
Nach der Reaktion |
| Versuch | Volumen |
Volumen |
Volumenverhältnis |
Volumen |
Volumen |
A |
60 ml |
60 ml |
60:60 = 1:1 |
30 ml |
0 ml |
B |
20 ml |
60 ml |
20:60 = 1:3 |
0 ml |
20 ml |
C |
30 ml |
60 ml |
30:60 = 1:2 |
0 ml |
0 ml |
Wie aus der Tabelle ersichtlich, liegt eine vollständige
Reaktion nur dann vor, wenn das Volumenverhältnis
Sauerstoff:Wasserstoff gleich 1:2 ist (Versuch C), denn dann
bleiben keine Ausgangsstoffe mehr zurück. Aus diesem
Volumenverhältnis kann man auch die Versuche A und B erklären:
![]() Versuch A:
Versuch A:
60 ml Wasserstoff können mit maximal 60/2 = 30 ml Sauerstoff
reagieren (Volumenverhältnis Sauerstoff:Wasserstoff = 30:60 =
1:2). Nach der Reaktion bleiben also noch 30 ml unreagiertes
Sauerstoffgas zurück.
Versuch B:
20 ml Sauerstoff können mit maximal 2*20 = 40 ml Wasserstoff
reagieren (Volumenverhältnis Sauerstoff:Wasserstoff = 20:40 =
1:2). Nach der Reaktion bleiben also noch 20 ml unreagiertes
Wasserstoffgas zurück.
Aus dem Volumenverhältnis Sauerstoff:Wasserstoff gleich 1:2
kann man nun das Massenverhältnis Sauerstoff:Wasserstoff in der
Verbindung Wasser errechnen.
Aus Versuch C:
- für das Wasserstoffgas:
m(Wasserstoff) = Volumen(Wasserstoff) * rho(Wasserstoff)
Volumen(Wasserstoff) = 60 ml = 0,06 l. Rho(Wasserstoff) = 0,0695 g/l. Durch Einsetzen erhält man:
m(Wasserstoff) = 0,06 l * 0,0695 g/l = 0,00417 g
- für das Sauerstoffgas:
m(Sauerstoff) = Volumen(Sauerstoff) * rho(Sauerstoff)
Volumen(Sauerstoff) = 30 ml = 0,03 l. Rho(Sauerstoff) = 1,103 g/l. Durch Einsetzen erhält man:
m(Sauerstoff) = 0,03 l * 1,103 g/l = 0,033 g
- Massenverhältnis Wasserstoff:Sauerstoff = m(Wasserstoff)/m(Sauerstoff) in der Verbindung Wasser:
m(Wasserstoff) 0,00417 -------------- = --------- = 0.126 m(Sauerstoff) 0,033
Schlussfolgerung:
Das Massenverhältnis der Elemente, aus denen eine Verbindung
besteht, ist konstant.
Das Gesetz der konstanten Massenverhältnisse ist gültig für
Feststoffe, Flüssigkeiten und Gase.
Welchen praktischen Nutzen kann man nun aber aus diesen Versuchen
und Resultaten ziehen? Dalton baute auf diesen Ergebnissen sein
Teilchenmodell der Materie auf:
5.3 Deutung der Massengesetze
![]() Zurück zu
Massengesetze und ihre Deutung
Zurück zu
Massengesetze und ihre Deutung
![]() Zurück zum
Inhaltsverzeichnis
Zurück zum
Inhaltsverzeichnis