Das Teilchenmodell der Materie besagt, dass die Materie aus kleinsten Teilchen besteht. Dieses Modell ist äußerst nützlich, um eine Deutung der Massengesetze zu erlauben.
In einem ersten Teil wird diese Deutung an einem Beispiel
veranschaulicht:
5.3.1 Deutung am Beispiel von Kupferoxiden
Der englische Chemiker Dalton versuchte aus
den Massengesetzen, Hypothesen über den Aufbau der Materie
aufzustellen. Im Laufe der Zeit wurden diese Hypothesen neuen
Erkenntnissen angepasst, und zum Atommodell ausgeweitet:
5.3.2 Das Atommodell nach Dalton
Die Bestimmung der Masse der Atome war lange Zeit ein
schwieriges Problem. Erst der Massenspektrograph erlaubte eine
exakte Messung:
5.3.3 Die Massen der Atome
Kennt man die Massen der Atome, so ist es ein Leichtes, mit
experimentell ermittelten Daten die chemischen Formeln von
Verbindungen aufzustellen:
5.3.4 Formeleinheiten, Verhältnisformel,
Molekülformel
Das Periodensystem der Elemente enthält eine Unmenge an
wichtigen Informationen. So wird es möglich, die Formel von
Verbindungen vorherzusagen, indem man bestimmte Regeln beachtet.
5.3.5 Erstellung einer Formel mithilfe der
Wertigkeit (Valenz)
5.3.1 Deutung am Beispiel von Kupferoxiden
Das Teilchenmodell der Materie besagt, dass das Element Kupfer
aus kleinsten Teilchen Kupfer besteht, und das Element Sauerstoff
aus kleinsten Teilchen Sauerstoff. Diese beiden Teilchenarten
unterscheiden sich in ihrer Masse und ihrem Volumen.
Bekannte experimentelle Daten über Kupferoxid:
A. Schwarzes Kupferoxid
Im schwarzen Kupferoxid stehen die Elemente Kupfer und Sauerstoff
in folgendem Massenverhältnis:
m(Kupfer):m(Sauerstoff) = 3,97:1
Oder anders angeschrieben:
m(Cu) 3,97 ----- = ---- (1) m(O) 1
Nimmt man - unter Berücksichtigung des Teilchenmodells - an, dass:
a. die Kupferportion der Masse m(Cu) aus x Kupferteilchen besteht, und jedes Kupferteilchen eine Masse ma (Cu) besitzt, dann folgt:
m(Cu) = x * ma (Cu)
b. die Sauerstoffportion der Masse m(O) aus y Sauerstoffteilchen besteht, und jedes Sauerstoffteilchen eine Masse ma (O) besitzt, dann folgt:
m(O) = y * ma(O)
Durch Einsetzen in (1) erhält man:
x * ma(Cu) 3,97 ----------- = ---- (2) y * ma(O) 1
Nimmt man jetzt an, dass auf ein Kupferteilchen ein Sauerstoffteilchen kommt, dann kommen auf x Kupferteilchen auch x Sauerstoffteilchen.

Mit dieser Annahme ist die Anzahl der Kupfer- und Sauerstoffteilchen gleich, folglich ist x gleich y und daraus folgt:
x = y
Und:
x 1 - = - y 1
Setzt man dies in Gleichung (2) ein, so erhält man:
1 * ma(Cu) 3,97 ----------- = ---- 1 * ma(O) 1
Durch Vereinfachen:
ma(Cu) 3,97 ------- = ---- ma(O) 1
Durch Umsetzen:
ma(Cu) = 3,97 * ma(O) (3)
Schlussfolgerung:
Aus der Annahme, dass auf ein Kupferteilchen ein
Sauerstoffteilchen kommt, kann man ableiten, dass die Masse eines
Kupferteilchens 3,97 mal größer ist, als die Masse eines
Sauerstoffatomes.
Auch die chemische Formel lässt sich aus dieser Annahme
ableiten. Dazu schreibt man die jeweiligen Symbole an, zuerst das
Metallteilchen (Cu), gefolgt vom Nichtmetallteilchen (O). Dabei
steht jedes Symbol für jeweils ein Teilchen, die chemische
Formel von schwarzem Kupferoxid gibt an, dass ein Kupferteilchen
an ein Sauerstoffteilchen gebunden ist:
CuO Anzahlverhältnis Kupfer:Sauerstoff = 1:1
Die Stoffportion Kupferoxid (CuO) der Masse m(CuO) besteht aus x Teilchen CuO der Masse ma (CuO):
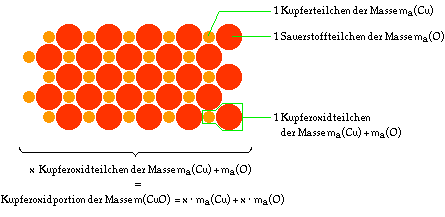
B. Rotes Kupferoxid
Rotes Kupferoxid ist durch folgendes Massenverhältnis
charakterisiert:
m(Kupfer):m(Sauerstoff) = 7,94:1
Oder anders angeschrieben:
m(Cu) 7,94 ----- = ---- (4) m(O) 1
Nimmt man - unter Berücksichtigung des Teilchenmodells - an, dass:
a. die Kupferportion der Masse m(Cu) aus x Kupferteilchen besteht, und jedes Kupferteilchen eine Masse ma (Cu) besitzt, dann folgt:
m(Cu) = x * ma (Cu)
b. die Sauerstoffportion der Masse m(O) aus y Sauerstoffteilchen besteht, und jedes Sauerstoffteilchen eine Masse ma (O) besitzt, dann folgt:
m(O) = y * ma(O)
Durch Einsetzen in (4) erhält man:
x * ma(Cu) 7,94 ----------- = ---- (5) y * ma(O) 1
Aus Gleichung (3) weiß man:
ma(Cu) = 3,97 * ma (O)
Durch Einsetzen in (5) erhält man:
x * 3,97 * ma (O) 7,94 ----------------- = ----- y * ma(O) 1
Durch Vereinfachung erhält man:
x * 3,97 7,94 --------- = ----- y 1
Durch Umsetzen erhält man:
x 7,94 - = ---- y 3,97
Durch Ausrechnen erhält man:
x 2 - = - y 1
Da x die Anzahl der Kupferteilchen darstellt und y die Anzahl der Sauerstoffteilchen heißt dies:
Auf 2 Kupferteilchen (x = 2) kommt ein Sauerstoffteilchen (y = 1)!

Die chemische Formel von rotem Kupferoxid kann nun aufgestellt werden. Zwei Kupferteilchen sind an ein Sauerstoffteilchen gebunden. Um dies in der chemischen Formel anzuzeigen, schreibt man die Zahl 2 als Index hinter das Kupfersymbol (eine 1 wird nicht als Index hinter das Sauerstoffsymbol geschrieben, da das Symbol ja schon für ein Sauerstoffteilchen steht).
Cu2O Anzahlverhältnis Kupfer:Sauerstoff = 2:1
Die Stoffportion Kupferoxid (Cu2O) der Masse m(Cu2O) besteht aus y Teilchen Cu2O der Masse ma(Cu2O):
Diese Überlegungen sind aber nur gerechtfertigt, wenn bei der Bildung von schwarzem Kupferoxid jeweils ein Teilchen Kupfer mit einem Teilchen Sauerstoff reagiert. Diese Annahme kann man nur beweisen, wenn man die Masse ma der Teilchen kennt.
Als vor fast 200 Jahren Dalton seine Hypothesen über den Aufbau der Materie aufstellte, war das Teilchenmodell der Materie noch nicht bekannt. Aus dem Gesetz der konstanten Massenverhältnisse zog Dalton erst den Schluss, dass die Materie aus kleinsten unteilbaren Teilchen, den Atomen aufgebaut sein muss.
Das Gesetz von der Erhaltung der Masse erklärte Dalton dadurch, dass die Elemente aus kleinsten unveränderlichen und unzerstörbaren Teilchen, den Atomen, aufgebaut sind. Bei einer chemischen Reaktion bleibt die Anzahl der Atome gleich, und somit bleibt auch die Masse erhalten. Danach besteht eine chemische Reaktion in einer Umgruppierung der Atome, wenn man von den Edukten zu den Produkten übergeht.
Das Gesetz von den konstanten Massenverhältnissen erklärte Dalton dadurch, dass die verschiedenen Atome in einem bestimmten Anzahlverhältnis und damit auch in einem bestimmten Massenverhältnis stehen.
Im Laufe der Zeit wurden diese Hypothesen neuen Erkenntnissen angepasst und zum Atommodell ausgeweitet. Das Atommodell nach Dalton besagt:
- Die Elemente bestehen aus kleinsten Teilchen, den Atomen. Die Atome können durch chemische Reaktionen nicht weiter geteilt werden.
- Die Atome eines Elementes sind untereinander gleich. Sie werden als kleine Kugeln dargestellt. Atome verschiedener Elemente unterscheiden sich in ihrer Masse und ihrer Größe.
- Wenn Atome chemische Verbindungen eingehen, dann ist das
Massenverhältnis und damit auch das Anzahlverhältnis der Atome
der Elemente in einer Verbindung konstant. Die Atome der
Verbindung werden durch die chemische Bindung zusammengehalten.![]()
- Bei einer chemischen Reaktion bleibt die Masse und damit auch die Anzahl der Atome gleich. Eine chemische Reaktion besteht daher in der Regel in der Trennung der chemischen Bindungen der Edukte und der Bildung der chemischen Bindungen der Produkte: es kommt zu einer Umgruppierung der Atome.
Zu Daltons Zeit gab es keine Möglichkeit, die Massen der
Atome zu bestimmen. Da man jedoch das Massenverhältnis der Atome
einer Verbindung experimentell bestimmen konnte, wurde es
möglich, relative Massen zu benutzen: Am Beispiel des
Kupferoxids (5.3.1
Deutung am Beispiel von Kupferoxiden) wurde deutlich, dass
die Masse des Kupferatoms etwa 3,97 mal größer sein muss als
die Masse des Sauerstoffatoms. Kennt man die Masse des
Sauerstoffatoms, so kann man ohne weiteres die Masse des
Kupferatoms bestimmen.
Erst in unserem Jahrhundert wurde es möglich, mithilfe des Massenspektrographen
die relative Masse von Atomen exakt zu bestimmen.
Die Atome sind unvorstellbar klein, es ist also nicht
verwunderlich, dass auch die Massen der Atome sehr gering sind.
Einige Beispiele:
| Element | Masse eines Atomes in g |
Masse eines Atomes in u |
| Wasserstoff H | 1,674 * 10-24 |
1,0079 |
| Sauerstoff O | 2,657 * 10-23 |
15,9994 |
| Kohlenstoff C (Isotop der Masse 12) | 1,9927 * 10-23 |
12,0000 |
| Kupfer | 1,055 * 10-22 |
63,546 |
| Uran | 3,953 * 10-22 |
238,029 |
![]() Wie aus der
zweiten Kolonne (Masse eines Atomes in g) der Tabelle
ersichtlich, liegen die Massen der Atome in einem Bereich von
etwa 10-24 g bis 10-22 g. In der Tat sind
diese Zahlenwerte unvorstellbar klein, und es ist sehr mühsam,
diese Zahlenwerte zu benutzen, wenn man mit den Massen weniger
Atome Berechnungen anstellen muss. Die Chemiker benutzen deshalb
eine Masseneinheit, welche dem atomaren Maßstab angepasst ist:
die atomare Masseneinheit u. Das u ist wie folgt definiert:
Wie aus der
zweiten Kolonne (Masse eines Atomes in g) der Tabelle
ersichtlich, liegen die Massen der Atome in einem Bereich von
etwa 10-24 g bis 10-22 g. In der Tat sind
diese Zahlenwerte unvorstellbar klein, und es ist sehr mühsam,
diese Zahlenwerte zu benutzen, wenn man mit den Massen weniger
Atome Berechnungen anstellen muss. Die Chemiker benutzen deshalb
eine Masseneinheit, welche dem atomaren Maßstab angepasst ist:
die atomare Masseneinheit u. Das u ist wie folgt definiert:![]()
1
1 u = --- der Masse des Kohlenstoffisotops der Masse 12 u
12
Wie die dritte Kolonne (Masse eines Atomes in u) der Tabelle zeigt, werden die
Massen der Atome in u durch wesentlich einfachere Zahlen
angegeben. Es ist auch viel leichter, Vergleiche der Massen
anzustellen, so kann man sofort erkennen, dass die Masse des
Sauerstoffatoms fast 16 mal größer ist als die Masse des
Wasserstoffatoms. Genau so gut erkennt man, dass die Masse des
Kupferatoms fast 4 mal größer ist als die Masse des
Sauerstoffatoms.![]()
Ebenso wie es zwischen kg und g einen Multiplikationsfaktor gibt
(1 kg = 1000 g), gibt es auch zwischen g und u einen
Multiplikationsfaktor:
1 g = 6,022 * 1023 u
Die Massen der Atome werden auch im Periodensystem der Elemente
angegeben (Der Zahlenwert, der über dem Elementensymbol steht).![]()
Für schwarzes Kupferoxid wurde folgende Gleichung aufgestellt (5.3.1 Deutung am Beispiel von Kupferoxiden):
x * ma(Cu) 3,97 ----------- = ---- (1) y * ma(O) 1
Da aber jetzt die Massen der Atome bekannt sind (Periodensystem der Elemente), ma (Cu) = 63,546 u und ma (O) = 15,9994 u kann man in (1) ersetzen:
x * 63,546 u 3,97 -------------- = ---- y * 15,9994 u 1
Durch Ausrechnen erhält man:
x * 3.97 3,97 --------- = ---- y 1
Durch Vereinfachen erhält man:
x 1 - = - y 1
Da x die Anzahl der Kupferatome angibt und y die Anzahl der Sauerstoffatome, zeigt sich nun, dass die Annahme in 5.3.1 Deutung am Beispiel von Kupferoxiden berechtigt war:
Auf ein Kupferatom kommt ein Sauerstoffatom!
Für rotes Kupferoxid wurde folgende Gleichung aufgestellt (5.3.1 Deutung am Beispiel von Kupferoxiden):
x * ma(Cu) 7,94 ----------- = ---- (2) y * ma(O) 1
Durch Einsetzen in (2) der Masse der Atome, ma (Cu) = 63,546 u und ma (O) = 15,9994 u erhält man:
x * 63,546 u 7,94 -------------- = ---- y * 15,9994 u 1
Durch Ausrechnen erhält man:
x * 3.97 7,94 --------- = ---- y 1
Durch Umsetzen erhält man:
x 7,94 - = ---- y 3,97
Daraus folgt:
x 2 - = - y 1
Da x die Anzahl der Kupferatome angibt und y die Anzahl Sauerstoffatome, kennt man nun das Anzahlverhältnis der Atome in der Verbindung:
In rotem Kupferoxid kommt auf zwei Kupferatome ein Sauerstoffatom.
Teilchenverband, Formeleinheiten und Verhältnisformel
Metalloxide und Sulfide (Verbindungen zwischen Metallen und
Schwefel) sind Feststoffe. Stoffportionen (Teilchenverband) eines
solchen Feststoffes sind aus einer großen Zahl von
Formeleinheiten aufgebaut. Die Formeleinheit ist ein Motiv, das
fortwährend im Teilchenverband wiederholt wird:
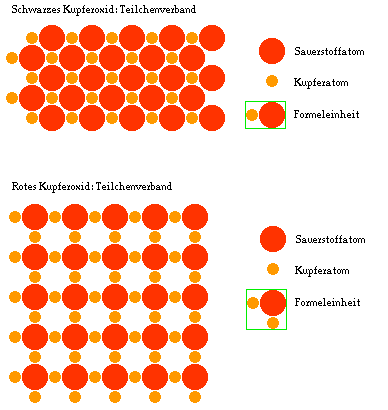
Aus der Formeleinheit kann man das Anzahlverhältnis der Atome
bestimmen. Die Anzahl der Atome wird durch ein großes N
angegeben.
Aus der Formeleinheit für schwarzes Kupferoxid erkennt man, dass
auf ein Kupferatom ein Sauerstoffatom kommt (Anzahl Kupferatome:
Anzahl Sauerstoffatome = 1:1):
N(Cu) 1 ----- = - N(O) 1
Die Verhältnisformel für schwarzes Kupferoxid gibt dieses
Anzahlverhältnis an. In jeder chemischen Formel (hier die
Verhältnisformel) wird die Anzahl der Atome hinter das
Atomsymbol als Index angeschrieben. Ist jedoch nur ein Atom
vorhanden, so gibt man dies einfach nur durch das Atomsymbol an.
Zuerst schreibt man das Symbol des Metalles an, gefolgt vom
Symbol des Nichtmetalles.
Folglich lautet die Verhältnisformel für schwarzes Kupferoxid:
CuO N(Cu):N(O) = 1:1
Aus der Formeleinheit für rotes Kupferoxid erkennt man, dass auf zwei Kupferatome ein Sauerstoffatom kommt (Anzahl Kupferatome: Anzahl Sauerstoffatome = 2:1):
N(Cu) 2 ----- = - N(O) 1
![]() Die
Verhältnisformel für rotes Kupferoxid gibt dieses
Anzahlverhältnis an. Folglich lautet die Verhältnisformel für
rotes Kupferoxid:
Die
Verhältnisformel für rotes Kupferoxid gibt dieses
Anzahlverhältnis an. Folglich lautet die Verhältnisformel für
rotes Kupferoxid:
Cu2O N(Cu):N(O) = 2:1
Molekülformel und Verhältnisformel
Flüssigkeiten und Gase bestehen meistens aus Molekülen (Feststoffe
können jedoch auch aus Molekülen aufgebaut sein). Die
Molekülformel gibt die Art und die Anzahl der Atome in einem
Molekül an. Molekülformel und Verhältnisformel können,
müssen aber nicht gleich sein.
Beispiele:
| Name | Molekülformel |
Verhältnisformel |
| Wasser | H2O |
H2O |
| Benzol | C6H6 |
CH |
| Essigsäure | C2H4O2 |
CH2O |
![]() Für Wasser
sind Molekülformel und Verhältnisformel gleich, da man das
Anzahlverhältnis N(H):N(O) = 2:1 nicht vereinfachen kann.
Für Wasser
sind Molekülformel und Verhältnisformel gleich, da man das
Anzahlverhältnis N(H):N(O) = 2:1 nicht vereinfachen kann.
Für Benzol sind Molekülformel und Verhältnisformel
verschieden, da man das Anzahlverhältnis N(C):N(H) = 6:6 in der
Molekülformel, durch Dividieren durch einen Faktor a = 6, zu
N(C):N(H) = 1:1 vereinfachen kann.
Für die Essigsäure sind Molekülformel und Verhältnisformel
verschieden, da man das Anzahlverhältnis N(C):N(H):N(O) = 2:4:2
in der Molekülformel, durch Dividieren durch einen Faktor a = 2,
zu N(C):N(H):N(O) = 1:2:1 vereinfachen kann.
Massen von chemischen Formeln
Beispiele:
- Masse der Formeleinheit von Eisensulfid FeS
N(Fe):N(S) = 1:1
Auf ein Eisenatom kommt ein Schwefelatom, die Masse der Formeleinheit ist folglich gleich der atomaren Masse von Eisen ma(Fe) plus der atomaren Masse von Schwefel ma(S):
ma(FeS) = ma(Fe) + ma(S)
Durch Einsetzen der Zahlenwerte der Atommassen erhält man:
ma(FeS) = 55,847 u + 32,066 u = 87,913 u
- Masse des Wassermoleküls H2O
N(H):N(O) = 2:1
Auf zwei Wasserstoffatome kommt ein Sauerstoffatom, die Masse der Molekülformel ist folglich gleich zweimal die atomare Masse von Wasserstoff ma(H) plus der atomaren Masse von Sauerstoff ma(O):
ma (H2O) = 2 * ma (H) + ma(O)
Durch Einsetzen der Zahlenwerte der Atommassen erhält man:
ma (H2O) = 2 * 1,0079 u + 15,9994 u = 18,0152 u
- Masse des Benzolmoleküls C6H 6
N(C):N(H) = 6:6
Auf sechs Kohlenstoffatome kommen sechs Wasserstoffatome, die Masse der Molekülformel ist folglich gleich sechs mal die atomare Masse von Kohlenstoff ma(C) plus sechs mal der atomaren Masse von Wasserstoff ma(H) :
ma (C6H6) = 6 * ma (C) + 6 * ma(H)
Durch Einsetzen der Zahlenwerte der Atommassen erhält man:![]()
ma (C6H6) = 6 * 12,011 u + 6 * 1,0079 u = 78,1134 u
Verallgemeinerung:
Für eine chemische Formel AaB bCc...
lautet die Masse:
ma(AaBbCc...) = a * ma(A) + b * ma(B) + c * ma(C) + ...
Die Wertigkeit oder Valenz eines Atomes gibt an, wie viele
Bindungen es eingehen kann.
Wasserstoff verbindet sich immer nur an ein anderes Atom, die
Wertigkeit von Wasserstoff ist daher 1.
Die Wertigkeit wird als kleiner Strich neben dem Atomsymbol
dargestellt:
H-
Die Wertigkeit anderer Atome kann man leicht ermitteln, falls
diese Atome Verbindungen mit Wasserstoff eingehen können:
- Chlorwasserstoff HCl
Wasserstoff besitzt die Wertigkeit 1 (H-) und bindet sich an ein
einziges Chloratom, folglich muss das Chloratom auch einwertig
sein ( Cl-).
![]()
- Wasser H2O
Das Sauerstoffatom ist an zwei Wasserstoffatome gebunden, da das
Wasserstoffatom die Wertigkeit 1 besitzt, muss das Sauerstoffatom
die Wertigkeit 2 besitzen.
![]()
- Methan CH4
![]() Das
Kohlenstoffatom ist an vier Wasserstoffatome gebunden, da das
Wasserstoffatom die Wertigkeit 1 besitzt, muss das
Kohlenstoffatom die Wertigkeit 4 besitzen.
Das
Kohlenstoffatom ist an vier Wasserstoffatome gebunden, da das
Wasserstoffatom die Wertigkeit 1 besitzt, muss das
Kohlenstoffatom die Wertigkeit 4 besitzen.
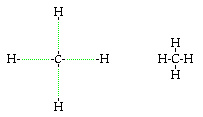
Für Elemente, die keine Verbindung mit Wasserstoff eingehen, ist
die Bestimmung der Wertigkeit sehr schwierig. Hier hilft das Periodensystem der Elemente weiter.
Aus dem Periodensystem kann man sehr leicht herauslesen, zu
welcher Hauptgruppe ein Element gehört. Kennt man die
Hauptgruppe (für die Nebengruppen gibt es keine allgemeinen
Regeln), so kann man mithilfe der folgenden Tabelle die
Wertigkeit des Elementes bestimmen:
| Element der Hauptgruppe | I |
II |
III |
IV |
V |
VI |
VII |
VIII |
| Wertigkeit (Valenz) | 1 |
2 |
3 |
4 |
3 |
2 |
1 |
0 |
Beispiele:
Aluminium befindet sich in der dritten Hauptgruppe, seine
Wertigkeit ist also 3.
Phosphor befindet sich in der fünften Hauptgruppe, seine
Wertigkeit ist also 3.
Ab der vierten Hauptgruppe können die Elemente auch noch
andere Wertigkeiten besitzen. Auch für die Nebengruppen gibt es
unterschiedliche Wertigkeiten.
Schwefel befindet sich in der sechsten Hauptgruppe, seine
Wertigkeit ist also normalerweise 2. Schwefel kann jedoch auch
die Wertigkeiten 4 und 6 besitzen. In diesen Fällen gibt man die
Wertigkeit hinter dem Atomsymbol mit römischen Ziffern in
Klammern an:
- für Schwefel mit der Wertigkeit 4: S(IV)
- für Schwefel mit der Wertigkeit 6: S(VI)
Dies gilt auch für die Elemente der Nebengruppen, für Kupfer
kennt man die Wertigkeiten 1 und 2:
- Kupfer mit der Wertigkeit 1: Cu(I)
- Kupfer mit der Wertigkeit 2: Cu(II)
Neben den Elementen gibt es aber auch charakteristische
Atomgruppen, die immer zusammen bleiben und deshalb auch eine
eigene Wertigkeit besitzen:
| Name | Symbol |
Wertigkeit |
| Phosphat | PO4 |
3 |
| Phosphit | PO3 |
3 |
| Sulfat | SO4 |
2 |
| Sulfit | SO3 |
2 |
| Carbonat | CO3 |
2 |
| Nitrat | NO3 |
1 |
| Nitrit | NO2 |
1 |
| Hydroxid | OH |
1 |
| Cyano | CN |
1 |
| Ammonium | NH4 |
1 |
Ermittlung der chemischen Formeln mithilfe der Valenz
a) zeichnerische Ermittlung
Beispiele:
- Wasser, eine Verbindung aus Wasserstoff und Sauerstoff
Wasserstoff H befindet sich in der 1. Hauptgruppe, seine
Wertigkeit ist 1.
Sauerstoff O befindet sich in der 6. Hauptgruppe, seine
Wertigkeit ist 2.

Im Wasser kommen 2 Wasserstoffatome auf 1 Sauerstoffatom, das Anzahlverhältnis ist also Folgendes:
N(H):N(O) = 2:1
Die chemische Formel des Wassers lautet also:
H2O
- Aluminiumoxid, eine Verbindung aus Aluminium und Sauerstoff
Aluminium Al befindet sich in der 3. Hauptgruppe, seine
Wertigkeit ist 3.
Sauerstoff O befindet sich in der 6. Hauptgruppe, seine
Wertigkeit ist 2.
In Aluminumoxid kommen 2 Aluminiumatome auf 3 Sauerstoffatome, das Anzahlverhältnis ist also Folgendes:
N(Al):N(O) = 2:3
Die chemische Formel des Aluminiumoxids lautet also:
Al2O3
b) rechnerische Ermittelung
Die rechnerische Ermittelung erlaubt eine problemlose Aufstellung
der chemischen Formel, wenn man folgende Schritte genau befolgt:
Beispiele:
a) Schwefel(VI)oxid
Schwefel(VI)oxid ist eine Verbindung aus Schwefel- und
Sauerstoffatomen.
Da in dem Namen der Verbindung auf den Namen Schwefel die
römische Zahl VI in Klammern folgt, besitzt das Schwefelatom in
dieser Verbindung die Wertigkeit 6.
Sauerstoff O befindet sich in der 6. Hauptgruppe, seine
Wertigkeit ist 2.

Die chemische Formel für Schwefel(VI)oxid lautet also SO3.![]()
b) Calciumphosphat
Calciumphosphat ist eine Verbindung aus Calciumatomen und
Phosphatgruppen.
Calcium Ca befindet sich in der 2. Hauptgruppe, seine Wertigkeit
ist 2.
Die Phosphatgruppe besitzt die Wertigkeit 3.

Die chemische Formel für Calciumphosphat lautet also Ca3(PO4)2.
Anmerkung:
Einige Elemente des Periodensystem kommen nur als Moleküle vor.
Dies sind die Elemente Cl, O, H, N, Br, I, F. Hintereinander
gesprochen ergibt dies etwa "Klohnbrief". Erinnert man
sich an "Klohnbrief", so kann man auch die Elemente
benennen die nur als Moleküle vorkommen. Alle anderen Elemente
werden einfach durch ihr Symbol dargestellt.
| Name | Molekülformel | Aggregatzustand |
| Chlor oder Chlorgas | Cl2 |
gasförmig |
| Sauerstoff oder Sauerstoffgas | O2 |
gasförmig |
| Ozon | O3 |
gasförmig |
| Wasserstoff oder Wasserstoffgas | H2 |
gasförmig |
| Stickstoff oder Stickstoffgas | N2 |
gasförmig |
| Brom | Br2 |
flüssig |
| Iod | I2 |
fest |
| Fluor oder Fluorgas | F2 |
gasförmig |
Sein Wissen über die Deutung der Massengesetze kann man
weiter überprüfen:
Massengesetze und ihre Deutung: Aufgaben
![]() Zurück zu Massengesetze und ihre Deutung
Zurück zu Massengesetze und ihre Deutung
![]() Zurück zum Inhaltsverzeichnis
Zurück zum Inhaltsverzeichnis