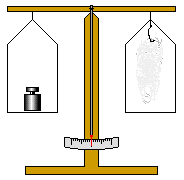
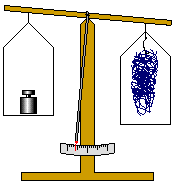
Versuch 1:
Ein Stückchen Eisenwolle wird auf einer Waage genau austariert. Dann entzündet man die
Eisenwolle mithilfe eines Bunsenbrenners.
| Vor der Reaktion: | Nach der Reaktion: |
 |
 |
Beobachtungen:
Die graue Eisenwolle verglüht und man erhält einen spröden
blau-grauen Feststoff. Da sich die Eigenschaften des
Ausgangsstoffes verändert haben, hat eine chemische Reaktion
stattgefunden.
Die Masse hat deutlich zugenommen.
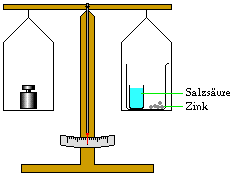
Versuch 2:
Ein Becherglas, welches Zinkstückchen und einen - mit
konzentrierter Salzsäure gefüllten - Glasbehälter enthält,
wird auf einer Waage genau austariert. Dann stürzt man den
Glasbehälter mit der konzentrierten Salzsäure um.
| Vor der Reaktion: | Nach der Reaktion: |
 |
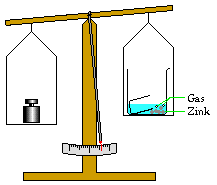 |
Beobachtungen:
Die Salzsäure reagiert unter heftigem Sprudeln mit dem Zink. Die
Zinkstückchen werden merklich kleiner. Ein Gas wird an die
Umgebung abgegeben.
Die Masse nimmt deutlich ab.
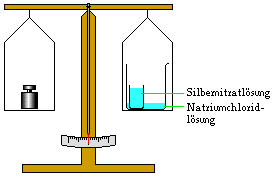
Versuch 3:
Ein Becherglas, welches eine Kochsalzlösung (Natriumchlorid) und
einen - mit einer Silbernitratlösung gefüllten - Glasbehälter
enthält, wird auf einer Waage genau austariert. Dann stürzt man
den Glasbehälter mit der Silbernitratlösung um.
| Vor der Reaktion: | Nach der Reaktion: |
 |
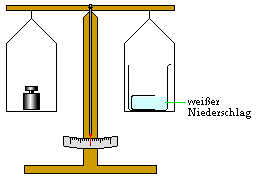 |
Beobachtungen:
Sofort bildet sich ein weißer Niederschlag.
Die Masse bleibt konstant.
Erklärungen:
![]() · Bei Versuch 1 reagiert ein
Brennstoff mit dem Sauerstoff, der in der Luft enthalten ist
(siehe: Zusammensetzung der Luft). Das
Eisen geht mit dem Sauerstoff der Luft eine Verbindung ein. Eisen
bindet also Sauerstoff an sich, deshalb nimmt die Masse zu.
· Bei Versuch 1 reagiert ein
Brennstoff mit dem Sauerstoff, der in der Luft enthalten ist
(siehe: Zusammensetzung der Luft). Das
Eisen geht mit dem Sauerstoff der Luft eine Verbindung ein. Eisen
bindet also Sauerstoff an sich, deshalb nimmt die Masse zu.
Diesen Versuch könnte man jedoch auch anders ausführen. Zum
Beispiel kann man ein Blitzlichtlämpchen genau abwiegen. Ein
Blitzlichtlämpchen besteht aus einem feinen Metalldraht, der in
reinem Sauerstoff eingeschlossen ist. Zündet man das Lämpchen
an, dann verbrennt der Metalldraht, indem er mit dem Sauerstoff
zu einer neuen Verbindung reagiert. Wiegt man das Lämpchen nach
der Verbrennung, so stellt man fest, dass die Masse konstant
geblieben ist.
Der zur Verbrennung nötige Sauerstoff ist im Glaskörper des
Lämpchens enthalten, es wird also kein Sauerstoff aus der
Umgebung aufgenommen: Die Masse bleibt konstant!
![]() · Bei Versuch 2, der Reaktion von
Salzsäure mit Zink, wird ein Gas an die Umgebung abgegeben
(Sprudeln). Dieses Gas wird natürlich nicht mehr mit abgewogen,
die Masse nimmt deshalb ab.
· Bei Versuch 2, der Reaktion von
Salzsäure mit Zink, wird ein Gas an die Umgebung abgegeben
(Sprudeln). Dieses Gas wird natürlich nicht mehr mit abgewogen,
die Masse nimmt deshalb ab.
Wenn man aber dieselbe Reaktion in einem Reagenzglas durchführt,
welches mit einem Luftballon verschlossen ist, dann kann das
entstehende Gas nicht an die Umgebung entweichen. Das Gas, das
bei der Reaktion entsteht, wird dann mit abgewogen und man stellt
fest, dass die Masse konstant bleibt!
![]()
· Bei Versuch 3 werden zwei Flüssigkeiten miteinander
vermischt. Bei der chemischen Reaktion der zwei Flüssigkeiten,
entsteht ein weißer Niederschlag, es wird weder ein Gas an die
Umgebung abgegeben, noch wird ein Gas aus der Luft aufgenommen.
Deshalb bleibt die Masse während der chemischen Reaktion
konstant.
Der französische Chemiker Lavoisier
war der Erste, der genaue Waagen als Messinstrumente im
chemischen Labor einsetzte. Er untersuchte systematisch die
quantitativen Beziehungen bei chemischen Reaktionen. Er stellte
fest, dass die Masse während einer chemischen Reaktion konstant
bleibt. Dies bedeutet auch, dass die Masse der Ausgangsstoffe
gleich der Masse der Endstoffe ist.
Lavoisier soll diese Zusammenhänge in dem folgenden kurzen Satz
festgehalten haben:
Die Einführung der Waage in das chemische Laboratorium
erlaubte auch, die optimalen Massenverhältnisse der
Ausgangsstoffe einer Reaktion zu bestimmen:
Gesetz von den konstanten Massenverhältnissen
![]() Zurück zu
Massengesetze und ihre Deutung
Zurück zu
Massengesetze und ihre Deutung
![]() Zurück zum
Inhaltsverzeichnis
Zurück zum
Inhaltsverzeichnis