4. Zusammensetzung der Luft
Wenn man Holz verbrennt, dann entstehen aus dem
Ausgangsmaterial viele neue Stoffe: Während des
Verbrennungsvorganges kann man weiße Dämpfe beobachten,
es bilden sich folglich Gase. Man kann auch
braun-schwarzen Rauch beobachten, es bilden sich also
auch leichte winzige Feststoffteilchen. Nach dem
Verbrennen bleibt eine geringe Menge Asche übrig. Bläst
man in die Holzkohle, so verläuft die Verbrennung
schneller.
Ähnliche Beobachtungen kann man beim Verbrennen in der
Luft von anderen Brennstoffen wie Kohle, Benzin oder
Wachs anstellen.
In der Luft ist also ein Stoff enthalten, der die
Verbrennung unterhält.
Versuch 1: Verbrennen von Phosphor unter einer
Glasglocke.
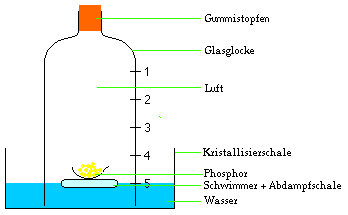
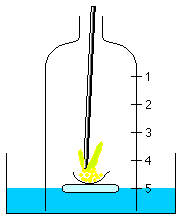
Der Phosphor kann leicht mit einem am unteren Ende erhitzten Eisenstab zum Brennen gebracht werden. Sobald der Phosphor brennt, wird die Glasglocke wieder mit dem Gummistopfen sorgfältig hermetisch verschlossen.
Beobachtungen:
Nach der Berührung des Phosphors mit dem Eisenstab,
beginnt der Phosphor sofort und schnell unter Bildung von
weißem Rauch zu verbrennen.
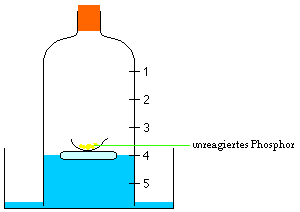
Auch nach dem schnellen und sorgfältigen
Verschliessen der Glasglocke brennt der Phosphor
zunächst weiter. Nach einer kurzen Zeit jedoch
erlöschen die Flammen plötzlich. Der weiße Rauch,
welcher bei der Verbrennung gebildet wurde, löst sich
langsam im Wasser auf. Der Wasserspiegel in der Glocke
ist von Marke 5 auf Marke 4 gestiegen, Außerhalb der
Glocke ist der Wasserspiegel weit unter Marke 5 gefallen:
Das Gasvolumen in der Glocke wurde von 5/5 auf 4/5
reduziert!
In der Abdampfschale bleibt noch unverbrannter
überschüssiger Phosphor zurück.
Durch Hinzufügen von Wasser in die Kristallisierschale,
wird der Wasserspiegel außerhalb der Glasglocke
dem Wasserspiegel in der Glasglocke angeglichen.
Man führt nun eine brennende Kerze tief in die
Glasglocke ein.
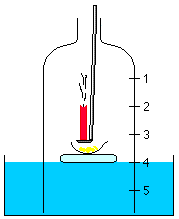
Beobachtungen:
Die Flamme der Kerze erlischt sofort!
Erklärungen:
Phosphor ist ein leicht brennbarer Stoff. Wie alle
Brennstoffe benötigt Phosphor dazu auch Luft. In der
Glasglocke ist am Anfang des Versuches ein Luftvolumen
von 5/5 vorhanden. Nach dem Verbrennungsvorgang bleiben
4/5 an Gasvolumen übrig. Ein 1/5 des Volumens wurde also
bei der Verbrennung des Phosphors verbraucht. Dieser Teil
der Luft, welche die Verbrennung unterhält, nennt man
Sauerstoff.
Nachdem der Sauerstoff verbraucht worden ist, hört der
Verbrennungsvorgang auf, obwohl noch genügend Phosphor
vorhanden ist. Der Restteil der Luft erstickt eine
Flamme, dies wurde auch im Versuch durch das Ersticken
der Flamme der Kerze nachgewiesen. Diese 4/5 des Volumens
der Luft werden als Stickstoff bezeichnet, da in diesem
Gas jede Flamme erstickt.
Dieser einfache Versuch zeigt, dass Luft ein
Gasgemisch ist, welches aus etwa 80% (4/5) Stickstoff und
20% (1/5) Sauerstoff besteht.
Reinen Sauerstoff kann man chemisch herstellen. In ihm
verlaufen Verbrennungen viel schneller und heftiger als
in der Luft. Darauf basiert die Nachweisreaktion von
reinem Sauerstoff:
Führt man einen glimmenden Holzspan in einen mit reinem
Sauerstoff gefüllten Glaszylinder ein, so fängt der
Holzspan zu brennen an.
Obwohl Stickstoff und Sauerstoff die Hauptbestandteile
der Luft sind, zeigen weiterführende Untersuchungen,
dass die Luft ein weit komplizierteres Stoffgemenge ist.
Versuch 2:
mithilfe einer Pumpe leitet man Luft durch eine klare
Kalkwasserlösung. Man wiederholt den Versuch, indem man
Atemluft in eine klare Kalkwasserlösung einleitet.
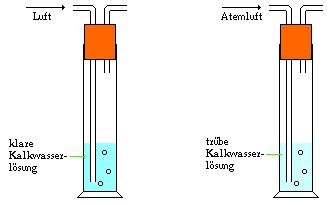
Beobachtungen:
Wenn Luft durch Kalkwasser geleitet wird, so kann man
keine Veränderung feststellen. Wird jedoch Atemluft
durch Kalkwasser geleitet, so kann man eine weiße
Trübung feststellen.
Erklärungen:
Beim Atmen nehmen Lebewesen Sauerstoff auf und beim
Ausatmen geben sie ein anderes Gas, Kohlenstoffdioxid, an
die Umgebung ab. Kohlenstoffdioxid reagiert mit
Kalkwasser, und es entsteht ein weißer Feststoff,
Calciumcarbonat, der dann in der Lösung als weißer
Niederschlag ausfällt. Diese Reaktion ist
charakteristisch für Kohlenstoffdioxid, es handelt sich
um eine Nachweisreaktion von Kohlenstoffdioxid.
Kohlenstoffdioxid entsteht bei der Verbrennung der
Nährstoffe im Körper. Auch bei normalen
Verbrennungsvorgängen von Holz, Kohle, Wachs oder Benzin
in der Luft, entsteht Kohlenstoffdioxid. Trotzdem ist der
Anteil an Kohlenstoffdioxid in der Luft sehr gering, etwa
0,035 %. Deshalb kann man auch keine rasche Trübung von
Kalkwasser erkennen, wenn man Luft durch eine klare
Kalkwasserlösung leitet. Durch den enorm gestiegenen
Verbrauch an Holz, Kohle und Benzin während den letzten
150 Jahren, ist der Kohlenstoffdioxidgehalt in der Luft
leicht angestiegen, um etwa 0,005%. Komplizierte
Regelmechanismen in der Natur (Pflanzen und Gewässer
nehmen einen Teil des Kohlenstoffdioxids auf) unterbinden
einen größeren Anstieg. Trotzdem führt der geringe
Kohlenstoffdioxidanstieg zum so genannten Treibhauseffekt.
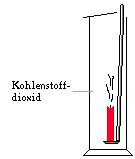
Versuch 3:
Man füllt einen Standzylinder mit reinem
Kohlenstoffdioxid. Dann führt man eine brennende Kerze
in den Standzylinder ein.
Beobachtung:
Die Kerze erlischt sofort.
Schlussfolgerung:
Kohlenstoffdioxid ist ein Gas in dem jede Flamme
erlischt.
Diese Eigenschaft von Kohlenstoffdioxid wird bei der
Brandbekämpfung genutzt: in den meisten Feuerlöschern
ist Kohlenstoffdioxid enthalten.
 |
Versuch 4:
Durch Hauchen an eine kalte Fensterscheibe kann man beobachten, dass Wasserdampf kondensiert. Beim Ausatmen wird also auch Wasserdampf an die Luft abgegeben. Durch Verdunsten der Gewässer ist in der Luft immer etwas Wasserdampf enthalten.
Des weiteren sind in der Luft geringe Mengen (< 1%) von Edelgasen wie Helium, Neon und Argon enthalten. Diese Gase sind sehr unreaktiv und sind deshalb einatomig.
Zusammenfassend ist die Zusammensetzung der Luft Folgende:
| Stickstoff | 78% |
| Sauerstoff | 21% |
| Edelgase | < 1% |
| Kohlenstoffdioxid | 0,03% |
| Wasserdampf | variabel |
| Staubpartikel | variabel |
| Abgase | variabel |