2.1 Theoretische Einteilung der Stoffe
Die Umgebung, in der wir leben, besteht aus
verschiedenen Gegenständen (Straßen, Häuser, Tische,
Stühle...).
Die verschiedenen Gegenstände erkennt man an ihrer Form
aber auch an dem Stoff oder dem Material, aus dem sie
aufgebaut sind. So kann man einen Stuhl oder einen Tisch
an ihrer Form erkennen. Diese Gegenstände sind meistens
aus dem Stoff Holz aufgebaut, man erkennt dies am
typischen Muster auf der Oberfläche dieser Gegenstände.
Es gibt aber auch Tische und Stühle aus Plastik, diesen
Stoff erkennt man oft an seinem geringen Gewicht.
Ein Stück Eisen erkennt man an dem typischen
metallischen Glanz, wenn man es frisch durchschneidet,
aber auch an seinem großen Gewicht. Oft erkennt man ein
Stück Eisen auch daran, dass es mit einer Rostschicht
überzogen ist.
Gold und Silber erkennt man auch an ihrem typischen Glanz
und ihrer Farbe.
Eis (Wasser in festem Zustand) schmilzt bei 0°C, der Schmelzpunkt
des Wassers beträgt 0°C. Wasser siedet bei 100°C, der Siedepunkt des
Wassers beträgt 100°C.
Farbe, Härte, Geschmack, Schmelz- und Siedetemperatur und so weiter sind Stoffeigenschaften. Durch ihre unterschiedlichen Eigenschaften kann man die einzelnen Stoffe voneinander unterscheiden.
Auch der Chemiker bedient sich der unterschiedlichen Stoffeigenschaften, um die Stoffe in verschiedene Gruppen einzuteilen.
- 2.1.1 Reinstoffe und Stoffgemenge
- 2.1.2 Einteilung der Reinstoffe und der Stoffgemenge
- 2.1.3 Schematische Zusammenfassung
- 2.1.4 Aufgaben
2.1.1 Reinstoffe und Stoffgemenge
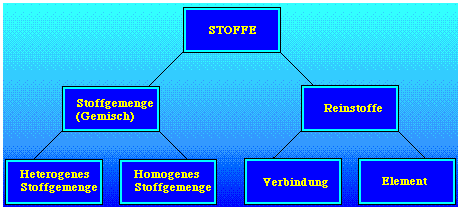
Da es eine sehr große Zahl an verschiedenen Stoffen gibt, teilt der Chemiker die Stoffe in verschiedene Gruppen ein. In einem ersten Schritt unterscheidet der Chemiker zwischen Reinstoffen und Stoffgemengen. Alle Stoffe sind daher entweder Reinstoffe oder Stoffgemenge. Schematisch kann man dies wie folgt darstellen:
- Stoffe
- Reinstoffe
- Stoffgemenge (Gemisch)
Ein Reinstoff besteht aus
einer einzelnen Stoffart.
Durch bestimmte Versuche kann der Chemiker herausfinden,
ob ein Stoff ein Reinstoff ist oder nicht.
Charakteristisch für Reinstoffe sind ihre konstanten
Eigenschaften: Schmelz- und Siedetemperatur, Farbe,
Geruch, Geschmack und so weiter sind immer die gleichen.
Folgende Stoffe sind Reinstoffe:
Zucker, Salz, Quecksilber, Eisen, Gold, Silber, reines
Wasser, feiner Sand.
Wirkliche Reinstoffe sind jedoch sehr schwer
herzustellen, auch in "reinem" Zucker oder Salz
sind noch geringe Mengen von anderen Stoffen enthalten.
Auch in der Natur sind die meisten Reinstoffe durch
winzige Mengen anderer Stoffe verunreinigt. Wenn aber die
Eigenschaften dieser leicht verunreinigten Stoffe fast
konstant sind, spricht man dennoch von Reinstoffen.
Vermischt man zum Beispiel den Reinstoff Zucker mit reinem Sand, so erhält man ein Gemenge, in dem man mit dem bloßen Auge noch Zuckerkristalle und Sandkörnchen ausmachen kann, die beiden Reinstoffe Sand und Zucker liegen daher im Gemisch nebeneinander vor.
Die Eigenschaften der Gemische ändern sich, wenn die Stoffe des Gemisches in verschiedenen Mengen vorhanden sind. Deshalb gibt es auch für Gemische keine Schmelz- und Siedepunkte sondern Schmelz- und Siedebereiche. Farben, Geruch und Geschmack von Gemischen sind veränderlich.
Vermischt man zum Beispiel eine große Menge Zucker mit ein wenig gelbem feinem Sand, so ist die Farbe des Gemisches fast weiß. Vermischt man jedoch eine große Menge gelben feinen Sand mit einer geringen Menge Zucker, so ist die Farbe des Gemisches gelb.
Stoffgemenge können durch Trennverfahren in ihre einzelnen Reinstoffe aufgetrennt werden.
2.1.2 Einteilung der Reinstoffe und der Stoffgemenge
Die Einteilung der Stoffe in Reinstoffe und Stoffgemenge ist ungenügend für den Chemiker, deshalb nimmt er erneut eine Einteilung der Reinstoffe und der Gemische vor:
- Stoffe
- Reinstoffe
- Element
- Verbindung
- Stoffgemenge (Gemisch)
- Heterogenes Gemisch
- Homogenes Gemisch
- Reinstoffe
a. Einteilung der Reinstoffe in Elemente und Verbindungen
Elemente
Seit etwa zweihundert Jahren
besitzt der Chemiker die Fähigkeit, durch Experimente
festzustellen, ob ein Stoff weiter zerlegt werden kann
oder nicht. Ist es unmöglich einen Stoff weiter zu
zerlegen, dann handelt es sich um einen Grundstoff oder Element.
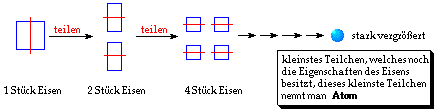
Beispiel: Man teilt ein Stück Eisen in zwei Teile, diese
beiden Eisenstückchen werden wiederum geteilt, und man
erhält vier Eisenstückchen. Wenn man dieses Teilen in
Gedanken immer weiter fortführt, kommt man an einen
Punkt, wo man das Eisenstückchen nicht mehr weiter
teilen kann, ohne seine Eigenschaften zu ändern. Dieses
kleinste Eisenteilchen nennt man ein Atom Eisen.
Heutzutage hat man etwa 110 verschiedene Elemente
nachgewiesen. Die Chemiker haben diese geringe Anzahl an
Elementen nach ihren Eigenschaften in einer Tabelle
zusammengefasst, das Periodische System der Elemente (PSE).
Jedes Element besitzt einen bestimmten Namen und ein
bestimmtes Symbol. Ein Symbol beginnt immer mit einem
Großbuchstaben. Ein kleiner Buchstabe kann, muss aber
nicht folgen (Berzelius-Regel).
Beispiele (Namen und Symbole von Elementen, die man
kennen sollte):
| Name | Symbol | Name | Symbol | |
| Aluminium | Al | Natrium | Na | |
| Argon | Ar | Neon | Ne | |
| Blei | Pb | Quecksilber | Hg | |
| Calcium | Ca | Sauerstoff | O | |
| Chlor | Cl | Silber | Ag | |
| Eisen | Fe | Silicium | Si | |
| Gold | Au | Schwefel | S | |
| Helium | He | Stickstoff | N | |
| Iod | I | Wasserstoff | H | |
| Kohlenstoff | C | Zink | Zn | |
| Kupfer | Cu | Zinn | Sn |
 |
Verbindungen
Verbindungen sind Reinstoffe,
die man in Grundstoffe oder Elemente zerlegen kann. Da
Elemente aus Atomen aufgebaut sind, sind Verbindungen aus
verschiedenen Atomarten aufgebaut.
Durch die Elektrolyse von Wasser kann man zeigen, dass Wasser
aus den Elementen Sauerstoff und Wasserstoff aufgebaut
ist. Wasser ist also eine Verbindung aus den Elementen
Sauerstoff und Wasserstoff.
Chemische Untersuchungen ergeben auch, dass zum Beispiel
Alkohol, Zucker, Fett und Essig aus den Elementen
Kohlenstoff, Wasserstoff und Sauerstoff aufgebaut sind.
Kochsalz ist aus den Elementen Natrium und Chlor
aufgebaut.
Heterogenes Gemisch
In einem heterogenem Gemisch
sind die einzelnen Stoffe des Gemisches gut zu erkennen.
Diese Gemenge sehen uneinheitlich aus.
Beispiele:
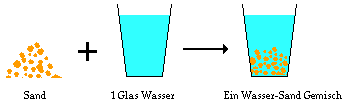
- Gibt man feinen Sand in ein
Glas Wasser, so erhält man eine Suspension. Der Sand sinkt langsam zum Boden des
Wasserglases. Man erhält ein Wasser-Sand Gemisch.
- Vermengt man Öl mit Wasser, so erhält man eine Emulsion. Das Öl bildet winzige Tröpfchen, die
im Wasser schweben. Lässt man die Emulsion längere Zeit
stehen, so trennen sich das Öl und das Wasser wieder.
- Feine Wassertröpfchen in der Luft bilden Nebel.
- Feine Feststoffteilchen in der Luft bilden Rauch (Zigarettenrauch, Rauch aus dem
Schornstein).

Homogenes Gemisch
Ein homogenes Gemisch sieht
einheitlich aus, das heißt, man kann die einzelnen
Stoffe des Gemisches weder mit dem bloßen Auge noch mit
dem Mikroskop erkennen. Diese Gemenge sehen aus wie
Reinstoffe.
Beispiele:
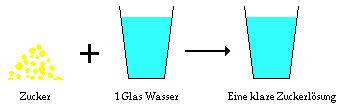
- Gibt man Zucker in ein Glas
Wasser, so löst sich der Zucker langsam auf, und man
erhält eine klare Zuckerlösung.
- Gibt man Salz in ein Glas Wasser, so löst sich das
Salz langsam auf, und man erhält eine klare Salzlösung.
- Gibt man einen wasserlöslichen Farbstoff in ein Glas
Wasser, so verteilt sich der Farbstoff langsam, und man
erhält eine einheitliche Farblösung.
 |
|
1. Auf einem Tisch stehen fünf
Trinkgläser, welche alle eine homogene farblose
Flüssigkeit enthalten. Jedes der Trinkgläser enthält
entweder Wasser, destilliertes Wasser, Wodka, eine
Zuckerlösung oder eine Salzlösung. Welche
Stoffeigenschaften erlauben es, die verschiedenen
Flüssigkeiten zu unterscheiden?
Lösung
2. Wie kann man einen unbekannten flüssigen Reinstoff
von reinem Wasser unterscheiden?
Lösung
3. Wie kann man einen unbekannten flüssigen Reinstoff
von einem unbekannten flüssigen Gemenge unterscheiden?
Lösung