2.2 Trennverfahren: Praktische Methoden zur Einteilung der Stoffe
Trennverfahren sind physikalische Vorgänge, beim Trennen wird die chemische Zusammensetzung der Stoffe nicht verändert. Die einzelnen Reinstoffe eines Gemenges können somit abgetrennt werden, ohne dass diese Reinstoffe verändert werden. Einige dieser Trennverfahren werden in diesem Kapitel vorgestellt.
- 2.2.1 Sedimentieren
- 2.2.2 Dekantieren
- 2.2.3 Filtrieren
- 2.2.4 Zentrifugieren
- 2.2.5 Abscheiden
- 2.2.6 Abdampfen
- 2.2.7 Extrahieren
- 2.2.8 Destillieren
- 2.2.9 Chromatografieren
- 2.2.10 Trennung mittels eines Magneten
- 2.2.11 Aufgaben
Unter Sedimentieren versteht man das Absinken von
feinen unlöslichen Feststoffteilchen in einer
Flüssigkeit.
Beispiel:

Wenn man etwa einen Teelöffel Gartenerde in einem
Glas Wasser umrührt, kann man beobachten, dass in dem
bräunlichen Gemisch größere Teilchen schnell zu Boden
sinken. Wenn man das Gemisch einen Tag stehen lässt, so
haben sich auch die leichtesten Teilchen am Glasboden
abgesetzt (sedimentiert). Die darüber stehende
Flüssigkeit ist klar.

Unter
Dekantieren versteht man das Abgiessen einer
Flüssigkeit, welche sich über einem unlöslichen
Feststoff oder einer unlöslichen Flüssigkeit befindet.
Beispiele:
- Das Fett einer Soße kann man mit etwas Geschick
größtenteils abgießen (dekantieren).
- Kaffee kann vom Kaffeesatz abgegossen (dekantiert)
werden.

- Wasser kann man größtenteils von Sand
abtrennen.
Aus diesen Beispielen kann man schon erkennen, dass die
Dekantation keine sehr genaue Trennmethode ist.

a.
Normale Filtration.
Durch eine Filtration kann man eine Flüssigkeit von
einem in ihr unlöslichen Feststoff trennen.
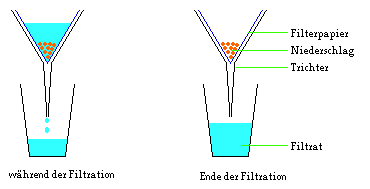
Um ein Gemisch zu filtrieren, gießt man das Gemisch
durch ein Sieb oder ein Filterpapier.
Falten des Filterpapiers:
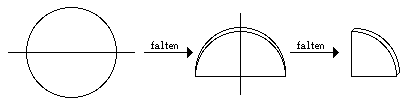
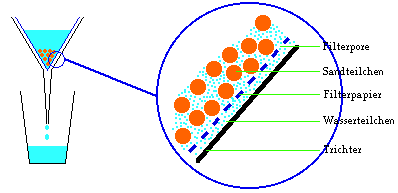
Die Flüssigkeit, welche aus sehr kleinen Teilchen
besteht, fließt problemlos durch die Poren des
Filterpapiers. Man bezeichnet die austretende
Flüssigkeit als Filtrat. Der unlösliche Feststoff
besteht aus Teilchen, die größer sind als die Poren des
Filterpapiers. Der Feststoff bleibt im Filterpapier
zurück, man bezeichnet diesen Feststoff als
Niederschlag.
Beispiel:

Filtration eines Wasser-Sand-Gemisches.
b. Filtration unter vermindertem Druck.
Obwohl die normale Filtration die Trennung eines
heterogenen Gemisches aus einer Flüssigkeit und einem
darin unlöslichen Feststoff erlaubt, besitzt sie zwei
große Nachteile:
- die Filtration verläuft relativ langsam
- eine vollständige Trennung ist fast unmöglich, es
bleibt immer noch etwas Flüssigkeit am Niederschlag
haften.
Unter vermindertem Druck verläuft eine solche Filtration
wesentlich schneller, auch wird durch den Unterdruck Luft
durch den Niederschlag gesogen und dadurch getrocknet.
Beispiel:
Filtration eines Wasser-Sand-Gemisches.
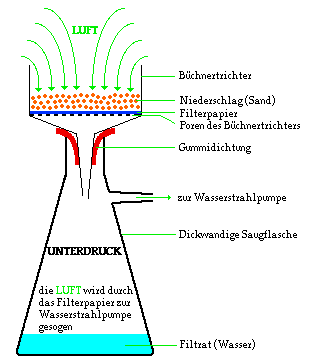
Der verminderte Druck wird durch eine
Wasserstrahlpumpe erreicht. In der Wasserstrahlpumpe
reißt ein feiner Wasserstrahl Luftteilchen mit sich.
Schließt man die Wasserstrahlpumpe an die Saugflasche
an, so werden Luftteilchen aus der Saugflasche angesogen.
Dadurch entsteht in der Saugflasche ein Unterdruck:
- Befindet sich noch Flüssigkeit im Büchnertrichter so
wird sie sehr schnell in die Saugflasche eingesogen, um
den Druck auszugleichen: Die Filtration unter
vermindertem Druck verläuft wesentlich schneller als
eine normale Filtration.
- Befindet sich nur noch ein wenig Restflüssigkeit im
Büchnertrichter, so wird Luft aus der Umgebung durch den
Niederschlag und das Filterpapier in die Saugflasche
eingesogen. Dadurch wird der Niederschlag getrocknet.
Wenn man einen sehr fein verteilten, unlöslichen
Feststoff aus einer Flüssigkeit filtrieren will, so ist
die normale Filtration unbrauchbar, da die Filtration
äußerst langsam verläuft, und die Poren des
Filterpapiers oft verstopfen.
Aber auch eine Filtration unter vermindertem Druck hilft
hier nicht weiter, da wiederum die Poren des Filters
verstopfen, und unter Umständen das Filterpapier reißt,
und eine Filtration daher nicht möglich ist.
In einem solchen Fall kann eine Zentrifugation
weiterhelfen. Dazu braucht man einen speziellen Apparat,
eine Zentrifuge. Eine Zentrifuge besteht hauptsächlich
aus einer Achse, an der man - an zwei beweglichen
Seitenarmen - dickwandige Reagenzgläser anbringen kann.
Beispiel:
Zentrifugation eines Wasser-Gartenerde-Gemisches.
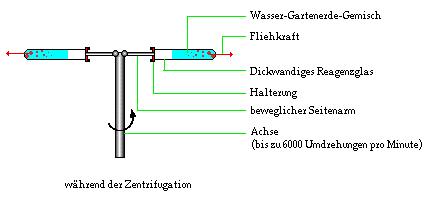
Schließt man den Apparat an, so dreht sich die Achse sehr schnell, bis zu 6000 Umdrehungen pro Minute. Durch die Fliehkraft werden die Reagenzgläser an den beweglichen Seitenarmen in die Waagerechte gebracht. Auch durch die Fliehkraft bedingt, verläuft die Flüssigkeit nicht. Die Fliehkraft drückt die Feststoffteilchen fest an den Boden des Reagenzglases. Da dies bei hohem Druck geschieht, bleiben die Feststoffteilchen auch noch nach der Zentrifugation am Boden haften.

Nach dem Lösen der Reagenzgläser aus der Halterung, kann man die Flüssigkeit dekantieren, ohne Feststoffteilchen mitzureißen, da die Feststoffteilchen sehr fest am Boden des Reagenzglases haften.

Durch
Abscheiden in einem Scheidetrichter kann man zwei
ineinander unlösliche Flüssigkeiten trennen.
Vermengt man beide Flüssigkeiten eng miteinander, dann
bildet sich ein heterogenes Gemisch, welches man als Emulsion
bezeichnet. Gibt man das Gemisch in einen
Scheidetrichter, dann trennen sich die beiden
Flüssigkeiten, und man erhält zwei Phasen: Die untere
Phase enthält immer die Flüssigkeit mit der größten Dichte, die obere
Phase wird immer durch die Flüssigkeit mit der kleineren
Dichte gebildet. Durch Öffnen des Hahnes kann man die
untere Phase von der oberen Phase trennen.
Beispiel:
Ein Öl-Wasser-Gemenge.
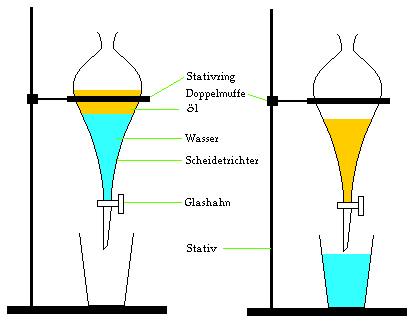
Öl besitzt eine kleinere Dichte als Wasser und bildet
daher die obere Phase im Scheidetrichter. Wasser bildet
die untere Phase.
Durch Abdampfen eines homogenen Gemisches (löslicher
Feststoff in einer Flüssigkeit) kann man den löslichen
Feststoff von der Flüssigkeit trennen. Die Flüssigkeit
geht aber bei diesem Vorgehen durch Verdampfen verloren.
Beispiel:
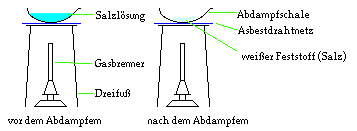
Nach dem Verdampfen des Wassers bleibt Salz als
weißer Feststoff zurück.
Unter Extrahieren versteht man das Herauslösen von
Stoffen mithilfe eines Lösungsmittels.
Man kann sowohl
- eine bestimmte Flüssigkeit aus einer anderen
Flüssigkeit herauslösen, als auch
- lösliche Feststoffe aus Flüssigkeiten oder aus
anderen Feststoffen herauslösen.
Dieses Verfahren beruht auf der unterschiedlichen
Löslichkeit der einzelnen Stoffe. Eine Extraktion kann
man in einem Scheidetrichter durchführen.
Beispiele:
Aufbereiten von Kaffee oder Tee. Dabei werden
wasserlösliche Stoffe aus dem Kaffeepulver
beziehungsweise aus dem Tee herausgelöst.
Eine Wasser-Ether Extraktion, um einen in Wasser schwer
löslichen Stoff in die Etherphase zu überführen, in
welchem der Stoff sehr löslich ist.
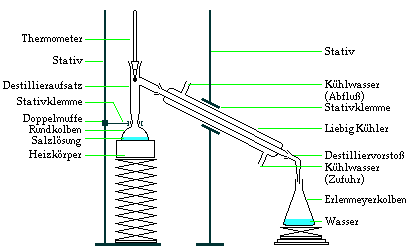
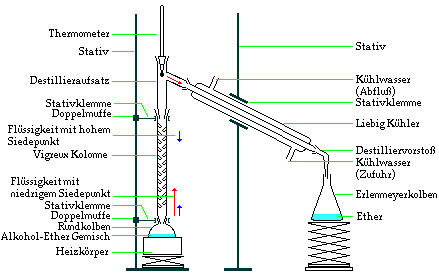
a) einfache Destillation
Mit einer einfachen Destillation kann man sehr leicht
lösliche Feststoffe von einem Lösungsmittel trennen.
Für Flüssigkeiten mit sehr großen
Siedetemperaturunterschieden ist auch eine Trennung
möglich.
In einem ersten Schritt wird das Stoffgemenge langsam
erhitzt. Die Flüssigkeit mit der kleinsten
Siedetemperatur steigt als Erste als Dampf in dem
Destillationsapparat nach oben. Der Dampf kondensiert im
Liebig-Kühler und kann dann in einem Erlenmeyerkolben
aufgefangen werden.
Beispiel:
Trennung einer Salzlösung.
b) Fraktionierte Destillation
Mittels einer fraktionierten Destillation kann man
mehrere ineinander lösliche Flüssigkeiten trennen.
Hierzu braucht man einen besonderen Glasapparat, ein
Destillationsgerät mit einer Vigreux-Kolonne.
In einem ersten Schritt wird das Stoffgemenge langsam
erhitzt. Die Flüssigkeit mit der kleinsten
Siedetemperatur steigt als Erste als Dampf in dem
Destillationsapparat nach oben. Die Vigreux-Kolonne
erlaubt dabei ein langsames aber stetes Ansteigen der
Temperatur. Durch diese feinen Temperaturunterschiede
wird auch die Trennung von Flüssigkeiten mit relativ
kleinen Siedepunktunterschieden möglich. Der Dampf
kondensiert im Liebig-Kühler und kann dann in einem
Erlenmeyerkolben aufgefangen werden.
Beispiel:
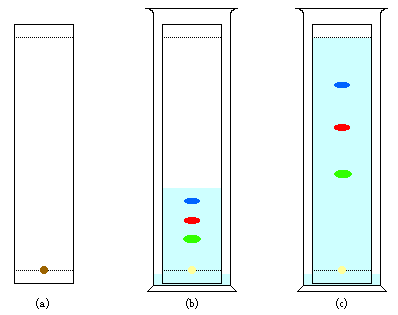
Durch Chromatografie kann man sehr komplizierte
Gemische in ihre Bestandteile auftrennen. Beispiel:
Auftrennung eines Farbstoffgemisches.
a. mithilfe eines Kapillars
bringt man eine geringe Menge Gemisch auf
Chromatografiepapier und lässt trocknen.
b. Dann gibt man das Chromatografiepapier in einen
schließbaren Glasbehälter, welcher ein Fließmittel
(Gemisch von Lösungsmitteln) enthält. Beim Aufsteigen
des Fließmittels werden die verschiedenen Farbstoffe
unterschiedlich weit mitgerissen. Je weniger ein Stoff
von dem Chromatografiepapier zurückgehalten wird, je
weiter wird er vom Fließmittel mitgenommen.
c. Wenn das Fließmittel die obere Markierung erreicht
hat, wird die Chromatografie durch Herausnahme aus dem
Glasbehälter und anschließendem Trocknen beendet.
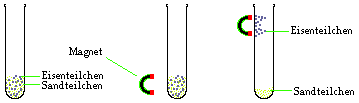
2.2.10 Trennung mittels eines Magneten
Eisen kann man mithilfe eines Magneten von anderen
Feststoffen oder Flüssigkeiten abtrennen.
Beispiel 1: Trennung von Eisenpulver und feinem Sand
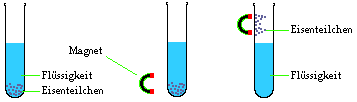
Beispiel 2: Trennung von Eisenpulver und einer
Flüssigkeit
1. Wie kann man ein Eisenpulver-Salz-Sand-Gemisch
vollständig auftrennen?
Lösung
2. Welche Stoffe eines
Eisenpulver-Zucker-Sand-Wasser-Gemenges kann man durch
Filtration abtrennen?
Begründe deine Antwort anhand eines Modells der
Filtration.
Lösung
3. Flüssige Luft ist hauptsächlich ein Gemisch aus
Sauerstoff (Siedetemperatur = -183°C), Stickstoff
(Siedetemperatur = -196°C) und Argon (Siedetemperatur =
-186°C).
Wie kann man flüssige Luft, welche auf -200°C
abgekühlt ist, in seine Reinstoffe auftrennen?
Lösung
4. Wie kann man ein Öl-Wasser-Ether-Sand-Salz-Gemisch
vollständig auftrennen?
Lösung