3.4 Übergänge zwischen den Aggregatzuständen
Versuch 1:
Ein Stück Eis wird langsam erhitzt. Der Feststoff Eis
geht bei diesem Vorgang langsam in die Flüssigkeit
Wasser über. Misst man die Temperatur, so bemerkt man,
dass diese konstant bei 0°C bleibt, so lange ein
Eis-Wasser-Gemisch vorliegt. Diese Temperatur nennt man
die Schmelztemperatur des Eises.
Bringt man die Flüssigkeit durch Erhitzen zum Kochen,
dann geht die Flüssigkeit Wasser in einen gasförmigen
Zustand über, es entsteht Wasserdampf. Misst man die
Temperatur, so bemerkt man, dass diese konstant bei
100°C bleibt, so lange ein Wasser-Wasserdampf-Gemisch
vorliegt. Diese Temperatur nennt man die Siedetemperatur
des Wassers.
Durch Zuführung von Wärmeenergie (erhitzen), kann man
also die Übergänge von fest zu flüssig (schmelzen) und
von flüssig zu gasförmig (verdampfen) erreichen.
Wasserdampf kondensiert sehr leicht an kalten Fensterscheiben und Wänden. Der Übergang von gasförmig zu flüssig (kondensieren) ist also durch Entzug von Wärmeenergie (abkühlen) möglich.
Ebenso kann man den Übergang von flüssig zu fest (erstarren) erreichen, indem man Wasser im Tiefkühlfach durch Wärmeentzug gefrieren lässt.
Versuch 2:
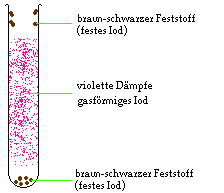
Durch Erhitzen von Iod (braun-schwarzer Feststoff)
entstehen violette Dämpfe (gasförmiges Iod). Am
kühleren oberen Teil des Reagenzglases kann man
denselben braun-schwarzen Feststoff erkennen wie am Boden
des Reagenzglases.
Wenn man also den Feststoff Iod erhitzt, kann man den
Übergang von fest zu flüssig nicht feststellen, es
findet durch Zufuhr von Wärmeenergie sofort der
Übergang von fest zu gasförmig statt (sublimieren).
Im oberen Teil des Reagenzglases kann man nur den
Übergang von gasförmig zu fest beobachten
(resublimieren). Durch Entzug von Wärmeenergie findet
sofort der Übergang von gasförmig zu fest statt.
Für verschiedene Stoffarten gibt es also nur die zwei
Aggregatzustände: fest und gasförmig.
Bemerkung: Ein Aggregatzustand besteht nur
für eine Stoffportion, also für eine große Anzahl von
Teilchen. Ein einzelnes Teilchen kann nicht in
verschiedenen Aggregatzuständen vorkommen.
Zusammenfassend kann man die verschiedenen Übergänge zwischen Aggregatzuständen wie folgt darstellen:
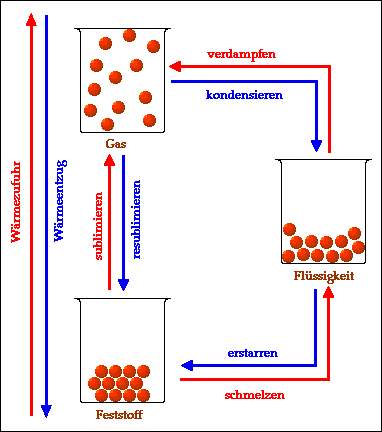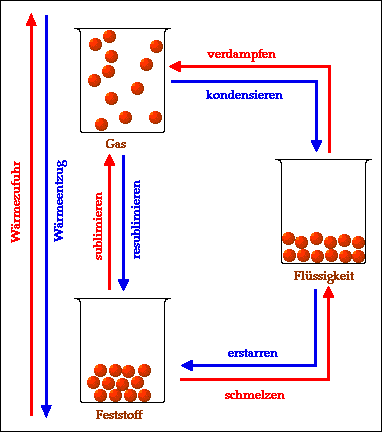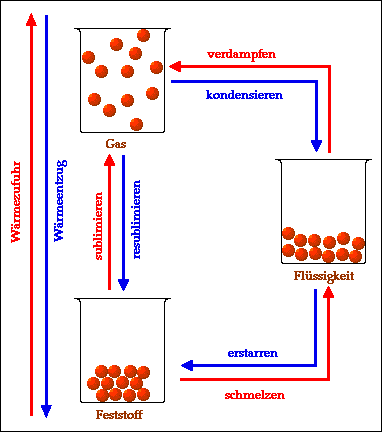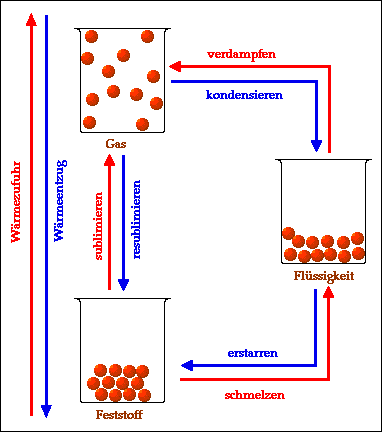
Durch Wärmezufuhr (erwärmen) werden folgende
Übergänge möglich:
- schmelzen (Übergang von fest zu flüssig)
- verdampfen (Übergang von flüssig zu gasförmig)
- sublimieren (Übergang von fest zu gasförmig).
Durch Wärmeentzug (abkühlen) werden folgende
Übergänge möglich:
- erstarren (Übergang von flüssig zu fest)
- kondensieren (Übergang von gasförmig zu flüssig)
- resublimieren (Übergang von gasförmig zu fest).
Sein Wissen über das Teilchenmodell der Materie kann man
weiter überprüfen:
3.5 Teilchenmodell der Materie:
Aufgaben