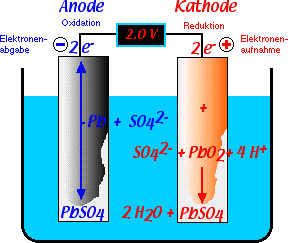
Beim Entladen verhält sich der Bleiakkumulator als galvanische Zelle. Das Halbelement der Anode besteht aus Blei (Pb), welches zu einem Blei-Kation (Pb2+) oxidiert wird. Das Halbelement der Kathode besteht aus Blei(IV)oxid (PbO2), welches zu demselben Blei-Kation (Pb2+) reduziert wird. Das Blei-Kation (Pb2+) bildet mit der Sulfat-Gruppe (SO42-) das schwerlösliche Salz Bleisulfat (PbSO4) welches sich auf den Elektroden und am Boden der Zelle absetzt.
Da für beide Halbzellen das Reaktionsprodukt das schwerlösliche Bleisulfat ist und auch die Elektrolytlösung gleich ist, wird in diesem Fall kein Diaphragma benötigt!
