Wenn eine einfache Trockenbatterie entladen ist, wird sie wertlos, man kann sie nur noch umweltfreundlich entsorgen. Akkumulatoren dagegen sind wiederaufladbar. Die elektrische Energie wird im Akkumulator sowie in einer Trockenbatterie durch chemische Reaktionen hergestellt: der Akkumulator stellt eine galvanische Zelle dar.
Der Luxemburger Henri Tudor war maßgeblich an der Entwicklung des Bleiakkumulators Ende des 18. Jahrhunderts beteiligt.

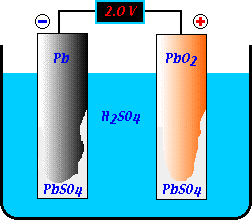
Der negative Pol des Bleiakkumulators besteht aus einer Bleiplatte (Pb) und der positive Pol aus einer Blei(IV)oxidplatte (Pb02). Als Elektrolytlösung wird Schwefelsäure (H2SO4) benutzt. Eine chemische Reaktion findet aber erst dann statt, wenn man den Stromkreis schließt: dann können Elektronen vom Minus- zum Plus-Pol fließen.
Elektronen werden bei der folgenden spontanen chemischen Reaktion freigesetzt:
Pb + 2 H2SO4 + PbO2
---> 2 PbSO4 + 2 H2O (globale chemische Reaktion)
Man spricht vom Entladen des Bleiakkumulators.
Um den Elektronenfluß zu benutzen schließt man zwischen die beiden Pole ein elektrisches Gerät (Elektromotor, Glühlampe, ...) an (durch Einfaches Verbinden mit einem Metalldraht ist der Akkumulator kurzgeschlossen!).
Mit Hilfe eines Spannungsmessers kann man die elektrische Spannung zwischen den beiden Polen der Zelle ermitteln: sie beträgt 2 Volt. In einer Autobatterie (12 V) sind sechs solcher Zellen in Reihe geschaltet.
Wie aus der Gleichung ersichtlich, wird bei dieser chemischen Reaktion Schwefelsäure (H2SO4) verbraucht, ein neues Produkt, Bleisulfat (PbSO4, ein weißer Feststoff) wird gebildet. Das Bleisulfat setzt sich entweder am Boden der Zelle ab, oder bildet einen Überzug auf der Blei- under der Blei(iV)oxid-Platte.
Je weiter der Bleiakkumulator sich entlädt desto mehr Bleisulfat wird gebildet und desto mehr Schwefelsäure wird verbraucht. Den Ladungszustand des Bleiakkumulators kann man deshalb mit Hilfe einer Dichtemessung der Schwefelsäure bestimmen:
Beim Entladen eines Bleiakkumulators bleibt das Volumen der Elektrolytlösung konstant, die Stoffmenge an Schwefelsäure und somit die Masse an Schwefelsäure nimmt jedoch ab. Folglich wird die Dichte rho der Schwefelsäurelösung geringer!
Um den Akkumulator aufzuladen, muß man Energie liefern (eine Spannung anlegen). Folgende globale chemische Reaktion wird dann erzwungen:
2 PbSO4 + 2 H2O
---> Pb + H2SO4 +PbO2
Man spricht vom Aufladen des Bleiakkumulators.
Dabei wird aus dem Bleisulfat wieder eine neue Blei- sowie auch eine neue Blei(IV)oxid-Elektrode hergestellt. Den Ladungszustand des Bleiakkumulators kann man wieder mit Hilfe einer Dichtemessung der Schwefelsäure bestimmen da ja wieder Schwefelsäure hergestellt wird. Wenn der Ladevorgang beendet ist, kann man das "Gasen" des Bleiakkumulators beobachten.
Der Bleiakkumulator wird hauptsächlich als Autobatterie benutzt.